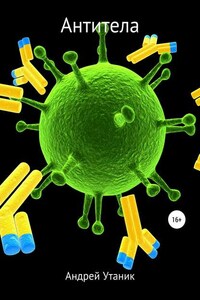
Антитела (иммуноглобулины, ИГ, Ig) – белковые соединения плазмы крови, образующиеся в ответ на введение в организм человека или теплокровных животных бактерий, вирусов, белковых токсинов и других антигенов. Связываясь активными участками (центрами) с бактериями или вирусами, антитела препятствуют их размножению или нейтрализуют выделяемые ими токсические вещества.[1]
Антитела являются особым классом гликопротеинов, имеющихся на поверхности B-лимфоцитов в виде мембраносвязанных рецепторов и в сыворотке крови. Антитела являются важнейшим фактором специфического гуморального иммунитета. Антитела используются иммунной системой для идентификации и нейтрализации чужеродных объектов – например, бактерий и вирусов. Антитела выполняют две функции: антиген-связывающую и эффекторную (вызывают тот или иной иммунный ответ, например, запускают классическую схему активации комплемента).
Антитела синтезируются плазматическими клетками, которыми становятся некоторые В-лимфоциты, в ответ на присутствие антигенов. Для каждого антигена формируются соответствующие ему специализировавшиеся плазматические клетки, вырабатывающие специфичные для этого антигена антитела. Антитела распознают антигены, связываясь с определённым эпитопом – характерным фрагментом поверхности или линейной аминокислотной цепи антигена.
Антитела состоят из двух лёгких и двух тяжёлых цепей. У млекопитающих выделяют пять классов антител (иммуноглобулинов) – IgG, IgA, IgM, IgD, IgE, различающихся между собой по строению и аминокислотному составу тяжёлых цепей и по выполняемым эффекторным функциям.
История изучения
Самое первое антитело было обнаружено Берингом и Китазато в 1890 году, однако в то время о природе обнаруженного столбнячного антитоксина, кроме его специфичности и его присутствия в сыворотке иммунного животного, ничего определённого сказать было нельзя. Только с 1937 года – исследований Тиселиуса и Кабата, началось изучение молекулярной природы антител. Авторы использовали метод электрофореза белков и продемонстрировали увеличение гамма-глобулиновой фракции сыворотки крови иммунизированных животных. Адсорбция сыворотки антигеном, который был взят для иммунизации, снижала количество белка в данной фракции до уровня интактных животных.
Строение антител
Антитела явяются относительно крупными (~150 кДа – IgG) гликопротеинами, имеющими сложное строение. Состоят из двух идентичных тяжёлых цепей (H-цепи, в свою очередь состоящие из VH, CН1, шарнира, CH2– и CH3-доменов) и из двух идентичных лёгких цепей (L-цепей, состоящих из VL– и CL– доменов). К тяжёлым цепям ковалентно присоединены олигосахариды. При помощи протеазы папаина антитела можно расщепить на два Fab (англ. fragment antigen binding – антиген-связывающий фрагмент) и один Fc (англ. fragment crystallizable – фрагмент, способный к кристаллизации). В зависимости от класса и исполняемых функций антитела могут существовать как в мономерной форме (IgG, IgD, IgE, сывороточный IgA), так и в олигомерной форме (димер-секреторный IgA, пентамер – IgM). Всего различают пять типов тяжёлых цепей (α-, γ-, δ-, ε– и μ-цепи) и два типа лёгких цепей (κ-цепь и λ-цепь).
Классификация по тяжёлым цепям
Различают пять классов (изотипов) иммуноглобулинов, различающихся:
последовательностью аминокислот
молекулярной массой
зарядом
гликозилированием
Класс IgG классифицируют на четыре подкласса (IgG1, IgG2, IgG3, IgG4), класс IgA – на два подкласса (IgA1, IgA2). Все классы и подклассы составляют девять изотипов, которые присутствуют в норме у всех индивидов. Каждый изотип определяется последовательностью аминокислот константной области тяжёлой цепи.
Конец ознакомительного фрагмента. Полный текст доступен на www.litres.ru